| ? | ||||||||||||
|
||||||||||||
| ? | ||
| 購(gòu)買進(jìn)口儀器、試劑和耗材——就在始于2001年的畢特博生物 www.603041.com |
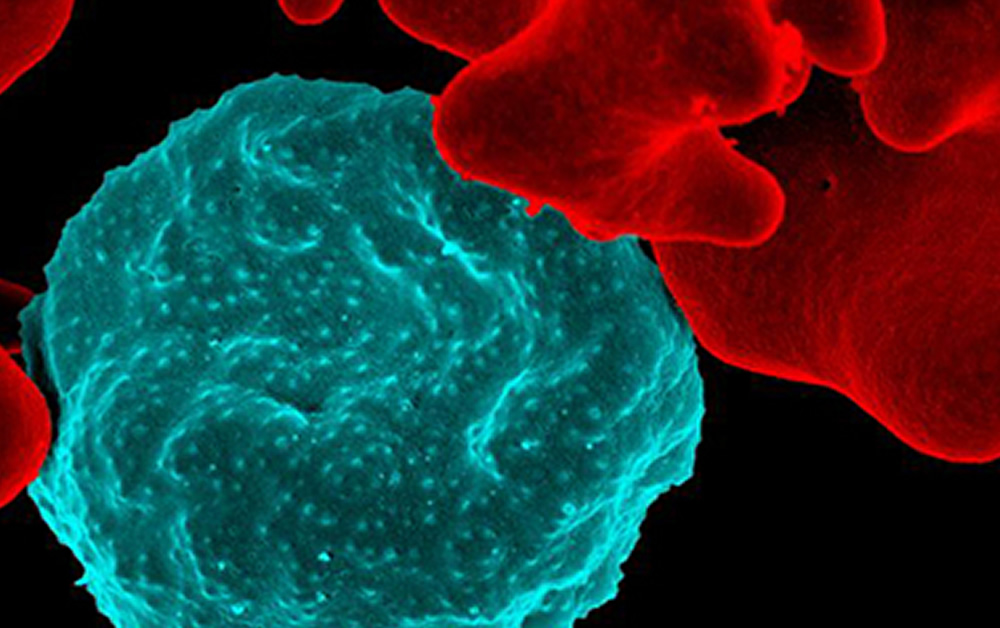 在電子顯微鏡照片中,被瘧原蟲感染的紅細(xì)胞為藍(lán)色,未感染的紅細(xì)胞為紅色。圖片來(lái)源:過(guò)敏和傳染病研究所 當(dāng)瘧原蟲侵入血紅細(xì)胞時(shí),它需要宿主細(xì)胞膜的一部分來(lái)建立一個(gè)防護(hù)艙。為了能夠正常生長(zhǎng),瘧原蟲竊取血紅細(xì)胞的營(yíng)養(yǎng)和往血紅細(xì)胞里面傾倒垃圾,然后對(duì)血紅細(xì)胞進(jìn)行一系列的改造,以將血紅細(xì)胞打造成適合瘧原蟲生存的一個(gè)家。 但新的研究表明,參與這些改造的蛋白質(zhì)必須通過(guò)瘧原蟲防護(hù)艙的一個(gè)小孔才能夠進(jìn)入血紅細(xì)胞中。當(dāng)科學(xué)家破壞細(xì)胞培養(yǎng)基中的孔通道時(shí),瘧原蟲停止生長(zhǎng)并死亡。 “瘧疾寄生蟲會(huì)分泌數(shù)百多樣的蛋白質(zhì)抓住并控制血紅細(xì)胞,” 本文第一作者、博士后研究學(xué)者喬希R.貝克博士說(shuō)。“我們一直在尋找一個(gè)所有的這些蛋白質(zhì)必須分泌的單一步驟,這看起來(lái)就像這樣一個(gè)瓶頸。” 由澳大利亞Burnet學(xué)院和迪肯大學(xué)的研究人員領(lǐng)導(dǎo)的另一項(xiàng)研究也在《Nature》發(fā)表了相同的問(wèn)題,也突出了小孔對(duì)瘧原蟲的生存的重要性。究人員認(rèn)為,阻塞小孔使寄生蟲進(jìn)入入致命的監(jiān)獄中,它再也無(wú)法從紅細(xì)胞中盜取資源或處置其廢物。 瘧原蟲,惡性瘧原蟲,是世界上最致命的病原體。瘧疾主要是通過(guò)感染的蚊子叮咬而傳播的,這種疾病最常見(jiàn)于非洲。根據(jù)世界衛(wèi)生組織報(bào)道,2012年,全球估計(jì)有2.07億瘧疾病例發(fā)生,導(dǎo)致627,000人死亡。瘧原蟲的許多種族產(chǎn)生耐藥性,研究人員正在努力尋找新的藥物靶標(biāo)。 本文的資深作者、華盛頓大學(xué)霍華德·休斯醫(yī)學(xué)研究所的研究員、分子微生物學(xué)和醫(yī)學(xué)教授丹尼爾·戈德堡博士,研究瘧疾如何影響紅細(xì)胞的。 在新的研究中,他和他的同事們觀察了熱休克蛋白101(HSP101)。科學(xué)家之所以將這個(gè)蛋白家族命名為“熱休克”,是因?yàn)楫?dāng)細(xì)胞過(guò)熱或高壓時(shí),這些蛋白就會(huì)變得活躍。這些蛋白質(zhì)具有多種功能,包括指導(dǎo)其他蛋白質(zhì)的折疊和展開(kāi)。 先前的研究已經(jīng)表明,HSP101可能參與蛋白質(zhì)的分泌。在細(xì)胞培養(yǎng)中,研究人員使HSP101喪失功能,希望阻止一些瘧疾蛋白的分泌。令他們吃驚的是,他們停止了所有的瘧疾蛋白的分泌。 “我們認(rèn)為這是一個(gè)非常有前途用于開(kāi)發(fā)藥物的靶標(biāo),” 戈德堡說(shuō)。 “要獲得一個(gè)新的藥物,我們還有很長(zhǎng)的路要走。但在短期內(nèi),我們可能會(huì)篩選出多種化合物,看看它們是否有阻止HSP101的潛力。” 科學(xué)家們認(rèn)為,HSP101可能準(zhǔn)備好用于分泌的瘧原蛋白,然后通過(guò)打開(kāi)瘧原蟲的小孔進(jìn)入紅細(xì)胞中。這個(gè)準(zhǔn)備工作的一部分可能涉及蛋白質(zhì)展開(kāi)為線性形式,使它們能夠更輕松地通過(guò)狹窄的小孔。HSP101也可能賜予蛋白質(zhì)一個(gè)生化踢,推動(dòng)它們通過(guò)小孔。 貝克指出,伯內(nèi)特研究所的研究人員通過(guò)禁用另一種蛋白質(zhì)(被認(rèn)為是參與蛋白質(zhì)通過(guò)這個(gè)孔的通道),使瘧原蟲類似的方式無(wú)效。 “這項(xiàng)研究表明我們也許能夠找到多個(gè)組件過(guò)程的藥物靶標(biāo),”他說(shuō)。 “此外,許多參與分泌的蛋白質(zhì)是不同于任何人類蛋白質(zhì),這意味著我們也許可以禁用它們而不會(huì)影響人體重要蛋白質(zhì)。” 原文摘要: PTEX component HSP101 mediates export of diverse malaria effectors into host erythrocytes Josh R. Beck, Vasant Muralidharan, Anna Oksman & Daniel E. Goldberg To mediate its survival and virulence, the malaria parasite Plasmodium falciparum exports hundreds of proteins into the host erythrocyte. To enter the host cell, exported proteins must cross the parasitophorous vacuolar membrane (PVM) within which the parasite resides, but the mechanism remains unclear. A putative Plasmodium translocon of exported proteins (PTEX) has been suggested to be involved for at least one class of exported proteins; however, direct functional evidence for this has been elusive. Here we show that export across the PVM requires heat shock protein 101 (HSP101), a ClpB-like AAA+ ATPase component of PTEX. Using a chaperone auto-inhibition strategy, we achieved rapid, reversible ablation of HSP101 function, resulting in a nearly complete block in export with substrates accumulating in the vacuole in both asexual and sexual parasites. Surprisingly, this block extended to all classes of exported proteins, revealing HSP101-dependent translocation across the PVM as a convergent step in the multi-pathway export process. Under export-blocked conditions, association between HSP101 and other components of the PTEX complex was lost, indicating that the integrity of the complex is required for efficient protein export. Our results demonstrate an essential and universal role for HSP101 in protein export and provide strong evidence for PTEX function in protein translocation into the host cell. |
購(gòu)買進(jìn)口儀器、試劑和耗材——就在始于2001年的畢特博生物
www.603041.com |
|